Gases
Un poco de historia de nuestra envoltura gaseosa… la atmósfera.
La atmósfera se compone de una solución de los diferentes gases que , en conjunto , constituyen el aire . Tres gases representan 99,96 % de la los gases en el aire seco por volumen . Estos gases son el nitrógeno (N2, el 78,1%), oxígeno (O2, el 20,9%) y argón (Ar, 0,93 %). Otros gases de la atmósfera son el vapor de agua ( H2O), dióxido de carbono (CO2), metano (CH4), ozono (O3), y óxido nitroso (NO2).
Sin dudas, la que conocemos actualmente no era la atmósfera original. Al menos se reconocen tres estados de la misma.
La primera estaba formada casi exclusivamente por helio e hidrógeno. Con la actividad volcánica, lanzado agua en forma de vapor, dióxido de carbono, amoníaco e hidrógeno. Se generó la segunda atmósfera.. Debido a la alta concentración de gases de efecto invernadero, el planeta era muy cálido, a pesar de que la radiación solar del Sol fue probablemente menos de lo que es hoy. Hace cerca de 3.3 millones de años, las cianobacterias, uno de los primeros las formas de vida, comenzaron a fotosintetizar, utilizando la energía solar para convertir dióxido de carbono y agua en alimentos en la forma de hidrocarburos. El subproducto de esta reacción es el oxígeno. Las acciones de las cianobacterias comenzaron a agregar oxígeno a la atmósfera por primera vez. Gran parte de este oxígeno no permaneció mucho tiempo en la atmósfera primitiva. Rápidamente se combinó con metales para formar óxidos(como por ejemplo con hierro para formar óxido de hierro) y con el amoníaco para formar nitrógeno y agua. Los niveles de oxígeno comenzaron a aumentar en la atmósfera como la tasa de producción de la fotosíntesis superó la tasa de oxidación. Los altos niveles de dióxido decarbono en la atmósfera se comenzaron a reducir a través de varios procesos. En primer lugar, las plantas convierten algo del dióxido de carbono en biomasa. Parte de la biomasa fue enterrada y se convirtió en combustibles fósiles como el carbón, el petróleo, y gas natural. Los océanos absorbieron parte del dióxido de carbono. Parte del dióxido de carbono disuelto fue usado en las reacciones químicas de precipitación del carbonato de calcio en el agua de mar.Algunos organismos evolucionaron y utilizaron el carbonato de calcio del agua para construir conchas. Las conchas de estos organismos muertos y el carbonato de calcio precipitado es convertidoen piedra caliza.
El amoníaco en la atmósfera reacciona con el oxígeno para la liberación nitrógeno gas. Algunas bacterias evolucionadas fueron capaces de utilizar el amoníaco como fuente de energía. Nuevos organismos, que podía utilizar el oxígeno, evolucionaron. Estos cambios en la atmósfera causaron grandes cambios en la composición de la vida en la Tierra. Todos estos procesos lentamente trabajaron juntos para crear lo que los científicos llaman la tercera atmósfera, que está dominada por el nitrógeno y el oxígeno. La presencia de oxígeno en la atmósfera primitiva llevó a la desarrollo de la capa de ozono en la estratosfera. Como el oxígeno extendido a la estratosfera, algunos de ellos recogidos en una región ahora conocida como la capa de ozono, que protege la superficie terrestre mediante la absorción de gran parte de la radiación ultravioleta del sol. Esta protección afectó la evolución de las plantas y los animales. Durante los tiempos de altas concentraciones de oxígeno, los animales prosperaron y muchos de las nuevas especies evolucionaron. Durante las épocas de poco oxígeno las extinciones masivas se llevaron a cabo. Las concentraciones actuales de nitrógeno y oxígeno han mantenido relativamente estables durante millones de años. Sin embargo, en los últimos años años, otro cambio en la atmósfera ha tenido lugar. La quema de combustibles fósiles ha estado causando la liberación de carbono de dióxido a la atmósfera. Esto ha resultado en un aumento de la concentración de dióxido de carbono en la atmósfera de alrededor de 280 partes por millón a cerca de 383 partes por millón desde 1850.
ACTIVIDAD N° 1
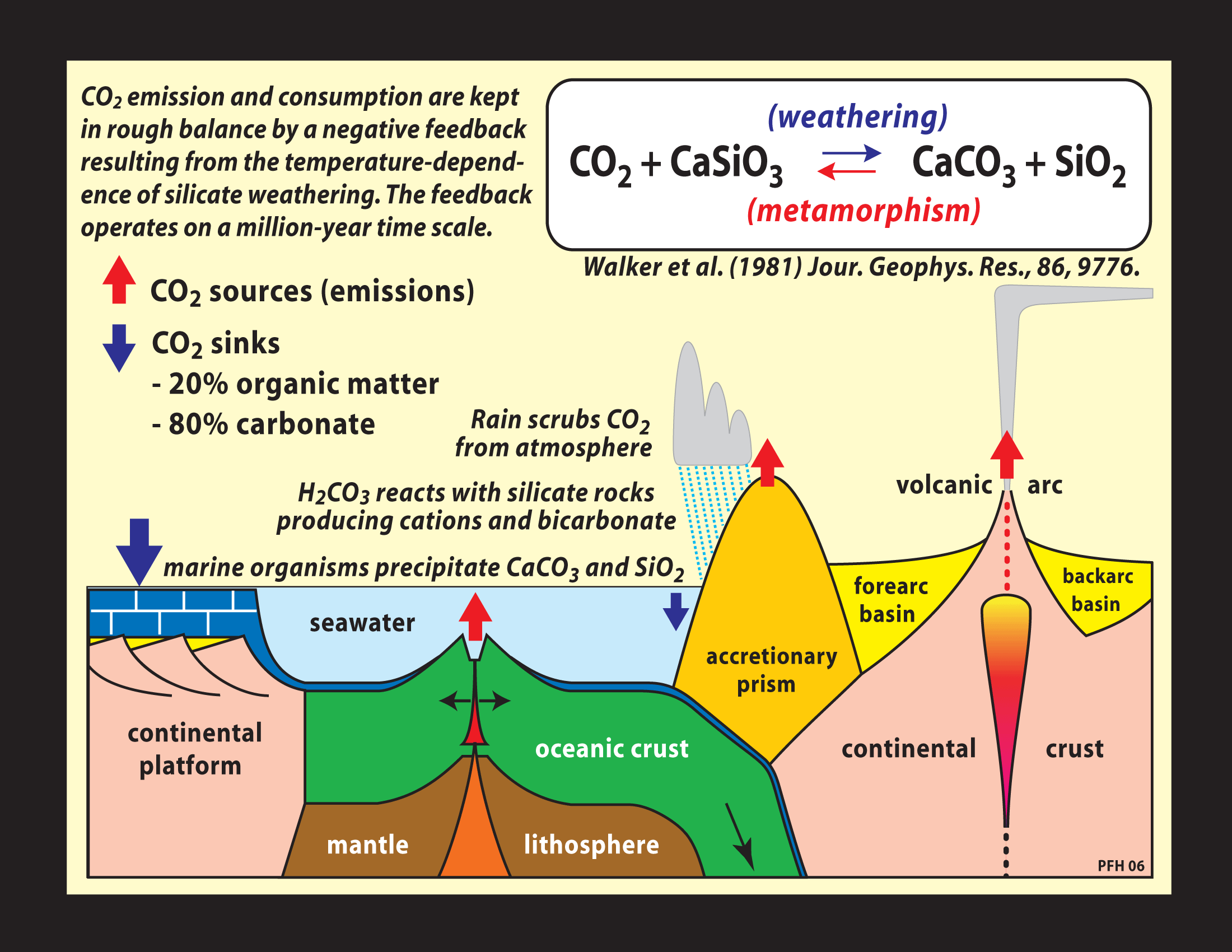
El carbono, al igual que otros elementos, sufre un intercambio entre los distintos subsistemas hidrósfera, atmósfera, biósfera y litósfera, llamado ciclo del carbono.
Te invitamos a que analices la siguiente imagen e identifiques procesos de liberación y consumo de CO2, así como los distintos reservorios de carbono en la naturaleza.
Como habrás podido observar el CO 2 es liberado por el vulcanismo y es consumido por los procesos de meteorización química como la hidrólisis de los silicatos.Te invitamos a que leas el artículo de Foster y Vance publicado en Nature, en 2006, sobre el tema del control que ejercen ciertos procesos geológicos en el ciclo del CO 2 .

ACTIVIDAD N° 2
Te invitamos a que participes con tus compañeros del foro “CO2, Geología y Clima”. La intención es que en ese espacio puedas intercambiar tus opiniones, dudas y aportes con respecto a lo leído en el artículo de Nature y al texto introductorio sobre la atmósfera. Como un complemento te presentamos la siguiente figura que sintetiza e integra lo desarrollado en el artículo.
Todo lo anterior nos ayuda a comprender la importancia que tiene para la geología el conocimiento de los gases, sus características y leyes que rigen su comportamiento. Por eso llegó la hora de dedicarnos a estudiar……
LOS GASES IDEALES
Cuando se enfrenta el estudio de un problema real se hace necesaria la separación arbitraria de una porción de materia llamada “sistema” que se relaciona directamente con el resto del espacio llamado “entorno”.
Para describir el estado de un sistema se puede adoptar un criterio microscópico o bien uno macroscópico.
En el enfoque microscópico, una descripción podría comprender los detalles del movimiento de todos los átomos o moléculas que componen el sistema y podemos decir que esto es una situación algo compleja, esto es lo que corresponde a la Teoría Cinética y a la Mecánica Estadística.
En el enfoque macroscópico, que es característico de la Termodinámica, el sistema viene descrito sólo por unas cuantas variables, conocidas como variables de estado.
Las variables de estado son:
- Númerode moles
- Presión
- Volumen.
- Temperatura.
Estás variables se relacionan por medio de leyes que son generalizaciones de resultados experimentales.
Las leyes que explican el comportamiento de los gases ideales:
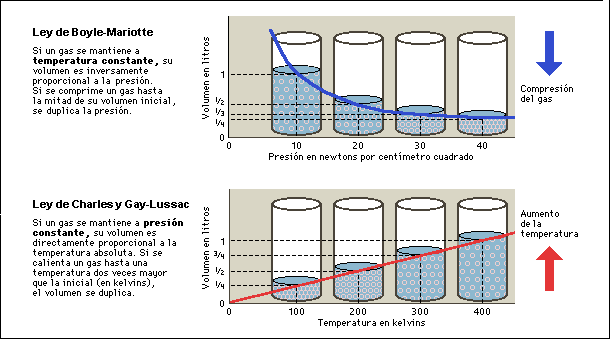
Ley de Boyle: relaciona el volumen y la presión de un gas en forma inversamente proporcional, manteniendo la temperatura constante:
Ley de Charles: afirma que el volumen de un gas, a presión constante, es directamente proporcional a la temperatura absoluta:
Ley de Gay Lussac: afirma que, a volumen constante, la presión de un gas es directamente proporcional a la temperatura absoluta del sistema:
Ley de Avogadro : a presión y temperatura constante el volumen de un gas es directamente proporcional al número de moles gaseosos.
Todas estas variables juntas conforman lo que se conoce como Ecuación de Estado . Por medio de esa expresión se puede definir una de las variables de estado conociendo las otras tres.
Todas estas leyes obedecen razonablemente bien al comportamiento de un gas ideal cuando el sistema se encuentra a presiones de alrededor de 1 atm y temperatura de 300 K (aproximadamente la temperatura ambiente) o mayores. A medida que nos alejamos de estas condiciones los gases muestran un comportamiento distinto dando lugar a lo que se conoce como gases reales.
ACTIVIDAD N° 3
En esta actividad te invitamos a ingreses al siguiente applet e investigues todas las combinaciones de relaciones de las variables de estado y compruebes las leyes de los gases ideales. Verás que puedes combinar más de un gas en el sistema, pudiendo de esta manera verificar la ley de las presiones parciales de Dalton.
Para evaluar esta actividad te pedimos que realices al menos 2 intervenciones en el foro “Leyes de los gases ideales” compartiendo con tus compañeros algunas de las relaciones verificadas o conclusiones obtenidas.
Recuerda que siempre puedes apoyarte en los resúmenes de clases que están disponibles en la sección archivos. Y ni que hablar de los LIBROS!!!
Para finalizar te pedimos que construyas un mapa conceptual usando como mínimo 4 conceptos y tres nexos. Esta herramienta te permitirá sintetizar y articular los principales conceptos que has trabajado en esta unidad.
